Home » Chemie
Archiv Kategorien: Chemie
Einblick in das Wahlpflichtfach Chemie: Extraktion von Citronensäure aus Zitronen
Zitronensaft enthält laut Literatur 5–7 % Citronensäure. Wieviel g Citronensäure sind dann in 450ml Zitronensaft enthalten? Dieser Fragen gingen zuletzt die Chemie-Wahlpflichtfach-schüler der 8.Klassen nach.
Citronensäure tritt als Stoffwechselprodukt in allen Organismen als Zwischenprodukt im Citratzyclus auf und ist auch im Pflanzenreich eine der am weitesten verbreiteten Säuren. Dieser Citratzyklus ist Dreh- und Angelpunkt im Kohlehydrat- und Fettsäure-Stoffwechsel aller sauerstoffatmenden Lebewesen einschließlich des Menschen. Der Citratzyklus liefert auch die Grundbausteine für den Aufbau der meisten Aminosäuren.
Ab 1784 wurde Citronensäure erstmals direkt aus Zitronen gewonnen. Diese Gewinnungsmethode ist einfach. Heute wird Citronensäure großtechnisch vor allem mit Hilfe von Gärungsprozessen erzeugt, bei denen als Ausgangsmaterial Traubenzucker oder Zuckerrübenmelasse und als Gärorganismus der Schimmelpilz Aspergillus Niger verwendet werden. Bei der Fermentation entsteht gelöste Zitronensäure, die anschließend gereinigt, konzentriert und kristallisiert wird.
Die Anwendungen dieser wichtigen Grundchemikalie sind vielfältig: Citronensäure ist in kalklösenden Reinigungsmitteln enthalten, da sie, anders als Essig, geruchlos ist. Sie dient als Säureregulator in Lebensmitteln, vor allem Getränken. Citronensäure verleiht den bekannten Center Shocks die Säure. Citronensäure und Citrate verhindern die Blutgerinnung, deshalb konserviert man Blutspenden in Beuteln, die eine Citrat-Pufferlösung enthalten. Citronensäure wird außerdem als Wasserenthärter und Weichspüler eingesetzt, sie dient zum Korrosionsschutz von rostfreiem Stahl, zur pH-Senkung in Kosmetika und als Rostentferner, Ester der Citronensäure werden in der Kunststofftechnik als Weichmacher v.a. für PVC eingesetzt.
Gewinnung: Ca. 50 Zitronen wurden gepresst, dann wurde die Zitronensäure durch Zugabe von Natronlauge NaOH zum Natriumcitrat neutralisiert. Dieses Natriumsalz wurden dann durch Zugabe von Calciumchlorid CaCl2 zum wasserunlöslichen Calciumcitrat umgesalzt und abfiltriert. Nächsten Montag werden wir dieses Calciumsalz wieder durch Zugabe von Schwefelsäure H2SO4 zur Citronensäure rückverwandeln.
Wir freuen uns schon auf die Kristallisation der wunderschönen Citronensäure-Kristalle!
Prof. Steiner-Enk und die Chemie-Begeisterten der 8. Klassen
Tag der offenen Tür an der Naturwissenschaftlichen Fakultät
Viel zu oft konzentriert man sich auf das Hier und Jetzt. Das Wahlpflichtfach Mathematik der 8. Klassen hat kurz vor der Reifeprüfung einen Blick in die nahe Zukunft gewagt und sich mit den Möglichkeiten eines weiteren Bildungsweges auf universitärem Niveau beschäftigt.
Der Tag der offenen Tür der Paris Lodron Universität Salzburg (PLUS) an der Naturwissenschaftlichen Fakultät (Nawi) am 13. März hat Einblicke in das Leben von Student:innen gegeben, naturwissenschaftliche Vorlesungen, dazugehörige Übungen und andere Lehrveranstaltungen erlebbar gemacht und so im ein oder anderen Entscheidungsprozess eindeutig weitergeholfen.
Natürlich haben auch die Begleitpersonen Hr. Direktor Porenta und Lukas Franta ihre Erfahrungen im Studium mit den Teilnehmer:innen geteilt.
Lukas Franta, MEd
Wie funktioniert eigentlich ein „Wasserstoff-Auto?“
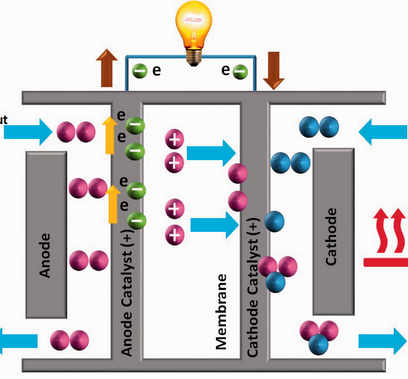
Im Wahlpflichtfach Chemie untersuchten Schüler:innen der 8. Klassen die Funktionsweise einer Wasserstoff-Brennstoffzelle anhand eines Modellautos.
Eine PEMFC (Proton Exchange Membrane Fuel Cell) verwandelt chemische Energie in elektrische Energie: Wasserstoff und Sauerstoff reagieren an einer Platin-Katalysator-Oberfläche zu Wasser 2 H2 + O2 -> 2 H2O. Die vom Wasserstoff H2 abgegebenen Elektronen werden über einen äußeren Stromkreis geführt und können so als elektrische Energie genutzt werden, als einzige Emission entsteht Wasser.
Durch die Brennstoffzelle läuft die sonst so heftige „Knallgasreaktion“ kontrolliert und kontinuierlich ab.
In unserem Modellauto konnte der benötigte Wasserstoff H2 durch vorherige Elektrolyse von Wasser – ebenfalls an der Brennstoffzelle – bereitgestellt werden. Die Energie zur Elektrolyse lieferte ein Solarmodul bei Bestrahlung mit Overhead-Projektor.
Schüler:innen der 8. Klassen,
Mag. Dr. Barbara Steiner-Enk, Chemie